“O fogo nos tornou humanos, os combustíveis fósseis nos tornaram modernos, mas agora precisamos de uma nova fonte de energia que nos torne seguros, saudáveis e duráveis.”
Define-se Combustível como qualquer substância cuja reação química seja exotérmica. 1 Entretanto, as condições de preço, de disponibilidade na natureza, ou de processo de fabricação comercial limitam o número de combustíveis usados na geração de energia elétrica.
Introdução
A Figura 1 apresenta os combustíveis utilizados na geração térmica de eletricidade considerando o seu estado físico nas condições ambientes.

A energia dos combustíveis se encontra armazenada na energia potencial da estrutura química das substâncias, e reações químicas liberam esta energia.
O Carvão surgiu na natureza a partir da decomposição de matéria orgânica de origem vegetal e o Petróleo a partir da decomposição de matéria orgânica de origem animal. Por isso, denominam-se de combustíveis fósseis o Carvão e os derivados de Petróleo.
O Carvão existe na natureza como uma mistura de Carbono com outros compostos inorgânicos baseados em Hidrogênio, Enxofre, Oxigênio e Nitrogênio. Seu uso se restringe a geração de energia2 e, graças a ele, a Revolução Industrial se tornou possível e salvaram-se as florestas da Europa e Asia.
O petróleo ocorre na natureza (petróleo cru) como uma mistura de hidrocarbonetos, compostos nitrogenados, compostos oxigenados, compostos sulfúricos, e compostos metálicos. Esses compostos podem conter outras impurezas, tais como água, sal e areia. Por isso, sua utilização em estado bruto na geração de energia se limita a aplicações muito especiais.
Ao contrário do Carvão, o Petróleo requer um processamento prévio para se tornar combustível. O refino e tratamento do petróleo permitem separar do petróleo os produtos mais adequados ao uso; gasolina, diesel, óleo combustível etc. Além do mais, o Petróleo fornece as matérias primas para a indústria Petroquímica, responsável por uma infinidade de produtos conhecidos popularmente como “plásticos”. Por isso, o Petróleo se tornou a mercadoria mais importante e estratégica no mundo.
O processo de destilação permite separar os componentes com temperatura de ebulição distintas.
A Figura 2 descreve o processo tradicional de destilação do petróleo, mas as faixas dos hidrocarbonetos predominantes dos principais combustíveis são indicativas.
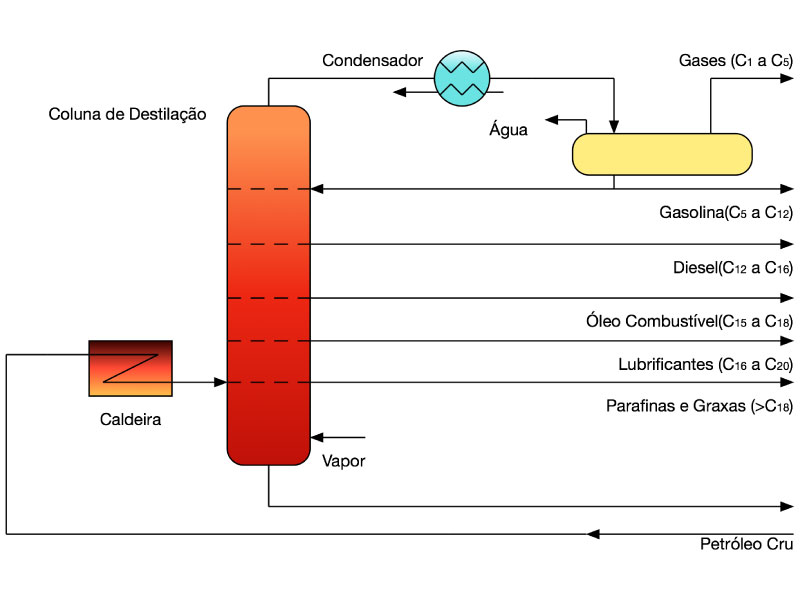
Os demais combustíveis apresentados na Figura 1, Bagaço de Cana, Biodiesel e Biogás, formam o grupo de combustíveis renováveis, a esperança atual para a nova fonte de energia segura, saudável e durável.
Contudo, ainda temos um longo caminho para que esta meta se torne realidade.
Propriedades Básicas dos Combustíveis
Independentemente do tipo, os combustíveis devem gerar calor para mover máquinas térmicas. Portanto, suas principais propriedades são:
-
- Poder Calorífico;
- Temperatura de Chama;
- Condições de ignição.
- Densidade de Energia;
- Estabilidade térmica;
- Pressão de Vapor;
- Toxicidade.
O Poder Calorífico determina a quantidade máxima de energia possível de ser extraída do combustível.
A Temperatura da Chama determina o projeto e materiais construtivos das máquinas térmicas. Temperaturas elevadas transferem mais energia, mas acarretam a utilização de materiais mais resistentes ao calor e, consequentemente, mais caros.
As condições de ignição determinam o tipo de máquina térmica mais adequado para determinado combustível.
A densidade de energia mede a quantidade de energia disponível em determinado volume de combustível. Os custos de transporte e armazenamento de combustível diminuem com o aumento da densidade de energia. Por isso, observamos na História da Energia que a humanidade caminha na direção de combustíveis com maior densidade de energia.
A estabilidade térmica do combustível determina o risco de armazenagem, combustíveis instáveis correm o risco de explodir espontaneamente.
A pressão de vapor indica a volatilidade do combustível. A maior volatilidade da gasolina com relação ao diesel provoca maior risco de explosão indevida. Por isso, restringe-se sua utilização em embarcações.
Por último, a toxicidade define o risco ambiental e de manipulação do combustível.
Poder Calorífico
O poder calorífico mede a máxima energia disponível pela combustão de determinado combustível.
Como a energia depende da quantidade de combustível, utiliza-se para o poder calorífico a unidade de energia/massa [J/kg]. Por isso, o poder calorífico é uma grandeza intrínseca.
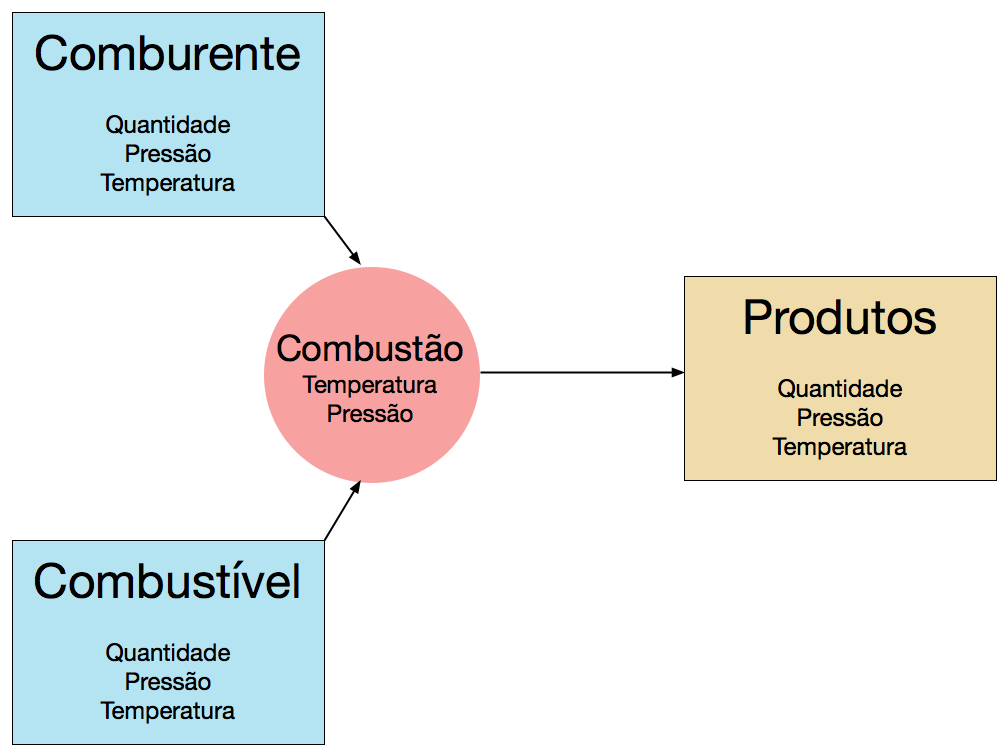
A Figura 3 ilustra o modelo mais simples do processo de combustão. Neste modelo, a combustão ocorre apenas em uma direção e não considera os aspectos estatísticos do processo. 3
Determinada quantidade de comburente e combustível, cada qual em determinada temperatura e pressão, se misturam na câmara de combustão.
Microscopicamente falando, átomos e moléculas das substâncias envolvidas devem se aproximar para que as reações químicas ocorram.
O tempo, as características das substâncias, e a forma de operação da câmara de combustão determinam a evolução da temperatura e pressão da mistura.
Se o tempo for relativamente longo, comparado com a constante de difusão do comburente e combustível, a mistura atingirá temperatura e pressão uniformes.
Em determinado momento, ocorre a ignição da mistura. Dependendo da máquina térmica, a ignição poderá ocorrer antes ou depois da mistura ter atingido as condições uniformes de temperatura e pressão.
Após a ignição, a combustão consome, ou não, toda a massa de combustível. Em determinado momento da operação da máquina térmica, os produtos da reação são expelidos em quantidade determinada pela reação química e em condições de temperatura, pressão e composição determinados pela máquina térmica.
A quantidade de energia máxima possível de ser absorvida pela máquina térmica será igual ou menor do que a diferença entre a energia de entrada (combustível + comburente) e a energia de saída dos produtos da combustão.
A Termodinâmica fornece a teoria para a avaliação do poder calorífico. A variação de Entalpia (energia) decorrente da combustão pode ser calculada a partir de:
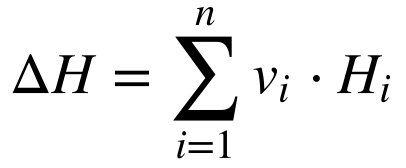
Onde:
-
- ΔH é a variação de Entalpia decorrente da combustão;
- n é o número total de substâncias que participam do processo;
- vi é o coeficiente estequiométrico da substância i;
- Hi é a Entalpia de Formação da substância i.
Define-se os coeficientes estequiométricos dos produtos da reação como positivos e os coeficientes dos reagentes como negativos em decorrência do sentido da reação. O resultado líquido da reação é a saída menos a entrada.
Consequentemente, reações exotérmicas apresentam variações de entalpia negativas e as endotérmicas variações positivas.
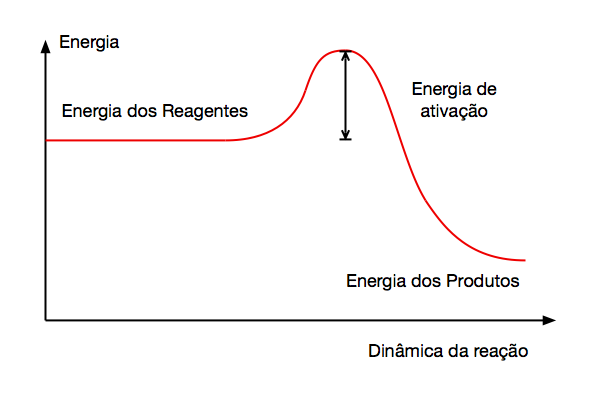
Por que a combustão, que libera energia, apresenta variação de entalpia negativa?
A Figura 4 fornece a explicação.
Isto ocorre porque a energia dos produtos da combustão é inferior à energia dos reagentes, o que acarreta a variação negativa de energia química armazenada no sistema. Consequentemente, pela lei da conservação de energia, a energia liberada na forma de calor tem igual valor.
Químicos utilizam este valor negativo porque trabalham com substâncias, mas engenheiros utilizam o valor inverso porque trabalham com energia.
Por isso, o Poder Calorífico se iguala ao negativo da entalpia de combustão.
Porém, para que a combustão não ocorra espontaneamente, os combustíveis necessitam que se forneça aos reagentes uma energia de ativação.
Substâncias que possuem energia de ativação baixa se tornam muito perigosas porque queimam ou explodem com facilidade.
O processo de combustão pode ocorrer de duas maneiras: à pressão constante ou a volume constante.
Segundo Winterbone, denomina-se Entalpia de Combustão a energia medida com pressão constante e Energia Interna de Combustão no caso de medição a volume constante. 4
Determina-se a Entalpia de Combustão a partir das entalpias de formação das substâncias utilizando a equação 1, considerando:
-
- A entalpia de formação dos elementos químicos igual a zero;
- A energia liberada pela combustão independente do caminho da reação, importando apenas o estado inicial e o estado final.
Exemplo
- Determine a Entalpia de Combustão do Carbono.
Obtem-se a entalpia de combustão do Carbono pela entalpia de formação do CO2 menos as entalpias de formação do Carbono e do Oxigênio.
De acordo com Yaws, a entalpia de formação dos elementos químicos é zero e a do dióxido de carbono é -393,50 kJ/mol. Logo, a entalpia de combustão do Carbono é -393,50 kJ/mol. 5
A energia térmica líquida liberada pela combustão depende da entalpia de combustão e das temperaturas dos reagentes e produtos. Por isso, tornou-se necessário definir as condições de ensaio e divulgação de valore, engenheiros trabalham com os conceitos de Poder Calorífico Superior (PCS) e Poder Calorífico Inferior (PCI).
O PCS, também denominado de Poder Calorífico Superior ou Bruto, considera o calor desprendido pela combustão de determinada quantidade de combustível a 25ºC e com os produtos da reação também na mesma temperatura.
A denominação de bruto decorre do fato que não existem perdas de energia para aquecer e/ou vaporizar substâncias envolvidas no processo.
Evidentemente, esta condição inexiste na prática porque máquinas térmicas reais expelem os produtos da combustão a temperaturas muito superiores à temperatura ambiente.
Consequentemente, houve a necessidade de se estabelecer o conceito do PCI, denominado de Poder Calorífico Inferior, para levar em consideração a operação real das máquinas térmicas.
Portanto, define-se PCI como a quantidade de calor gerada pela combustão de determinada quantidade de combustível, inicialmente a 25ºC, com a emissão dos produtos na temperatura de 150ºC.
Esta pequena diferença produz diferenças significativas no dimensionamento de usinas termelétricas.
No caso do PCS, a água resultante da combustão se encontra no estado líquido e no caso do PCI no estado gasoso.
Ao calcular o poder calorífico utilizando a equação 1, deve-se observar qual entalpia de formação da água foi utilizada.
A energia necessária para aquecer os reagentes até a temperatura de combustão representa uma perda no processo.
Todos os combustíveis que contém hidrogênio geram água após a combustão, e na prática a água se encontra na forma de vapor.
A energia gasta para vaporizar a água também representa uma perda e vem do calor da combustão.
A medição do poder calorífico dos combustíveis requer equipamentos precisos.
Na prática, utiliza-se o calorímetro mostrado na Figura 5.
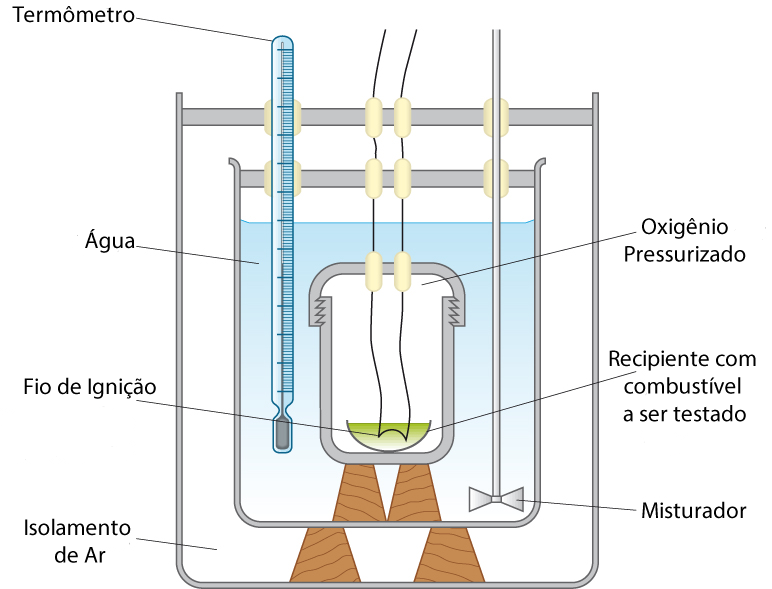
Nesse instrumento, a variação da temperatura da água no vaso ao redor da câmara de combustão determina a quantidade de energia liberada.
O isolamento de ar minimiza a troca de calor com o meio ambiente.
A variação da temperatura da água e sua massa determinam a energia liberada pela reação dentro do recipiente interno.
Como a temperatura do sistema se estabiliza em valores inferiores a 100 oC, a temperatura dos produtos da combustão é a mesma. Isto significa que a água gerada pela combustão no interior da câmara de combustão se encontra no estado líquido.6
Tabela 1. Poder Calorífico das Substâncias
| wdt_ID | Substância | Fórmula | Massa Atômica | PCS[kcal/kg] | PCI[kcal/kg] | PCS[kWh/kg] | PCI[kWh/kg] |
|---|---|---|---|---|---|---|---|
| 1 | Carbono | C | 12,01 | 7.819,00 | 7.819,00 | 9,09 | 9,09 |
| 2 | Hidrogênio | H2 | 2,02 | 33.900,00 | 28.642,00 | 39,40 | 33,29 |
| 3 | Monóxido de Carbono | CO | 28,01 | 2.412,00 | 2.412,00 | 2,80 | 2,80 |
| 4 | Enxofre | S | 32,06 | 2.210,00 | 2.210,00 | 2,57 | 2,57 |
| 5 | Gás Sulfídrico | H2S | 34,08 | 3.939,00 | 3.631,00 | 4,58 | 4,22 |
| 6 | Amônia | NH3 | 17,03 | 5.364,00 | 4.439,00 | 6,23 | 5,16 |
| 7 | Metano | CH4 | 16,04 | 13.249,00 | 11.940,00 | 15,40 | 13,88 |
| 8 | Etano | C2H6 | 30,07 | 12.384,00 | 11.336,00 | 14,39 | 13,17 |
| 9 | Propano | C3H8 | 44,09 | 12.018,00 | 11.065,00 | 13,97 | 12,86 |
| 10 | n-Butano | C4H10 | 58,12 | 11.822,00 | 10.919,00 | 13,74 | 12,69 |
| 11 | i-Butano | C4H1O | 58,12 | 11.794,00 | 10.891,00 | 13,71 | 12,66 |
| 12 | n-Pentano | C5H12 | 72,14 | 11.702,00 | 10.829,00 | 13,60 | 12,59 |
| 13 | i-Pentano | C5H12 | 72,14 | 11.680,00 | 10.252,00 | 13,57 | 11,92 |
| 14 | neo-Pentano | C5H12 | 72,14 | 11.635,00 | 10.761,00 | 13,52 | 12,51 |
| 15 | Eteno | C2H4 | 28,05 | 12.009,00 | 11.260,00 | 13,96 | 13,09 |
| 16 | Propeno | C3H6 | 42,08 | 11.674,00 | 10.925,00 | 13,57 | 12,70 |
| 17 | n-Buteno | C4H8 | 56,10 | 11.563,00 | 10.817,00 | 13,44 | 12,57 |
| 18 | i-Buteno | C4H8 | 56,10 | 11.502,00 | 10.754,00 | 13,37 | 12,50 |
| 19 | Acetileno | C2H2 | 26,04 | 11.929,00 | 11.527,00 | 13,86 | 13,40 |
| 20 | Etanol | C2H5OH | 46,07 | 7.302,00 | 6.619,00 | 8,49 | 7,69 |
| 21 | Metanol | CH30H | 32,04 | 5.692,00 | 5.037,00 | 6,62 | 5,85 |
| 22 | Fonte: Yaws |
Fonte: Yaws
Conforme mostra a Tabela 1, o Hidrogênio possui o maior Poder Calorífico, seguido pelo Metano, Propano, Carbono, Etanol e Metanol.
Por outro lado, o Carbono, elemento básico do carvão, apresenta o menor poder calorífico.
Por isso, os combustíveis derivados de petróleo substituíram o carvão após a revolução industrial, e ainda não se encontrou outro combustível que possa substitui-los.
Deve-se observar que, na prática, existem duas fontes de água no processo de combustão: os átomos de hidrogênio existente nas moléculas do combustível e as moléculas de água misturadas ao combustível e ao ar.
Para levar isto em consideração, de acordo com Garcia, pode-se calcular o PCI a partir do PCS através da Equação 2.
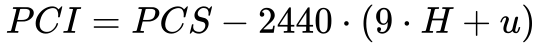
Onde:
-
- PCI é o Poder Calorífico Inferior [kj/kg];
- PCS é o Poder Calorífico Superior [kj/kg];
- H é o teor de hidrogênio no combustível [kg/kg em base seca];
- u é o teor de umidade do combustível [kg de água/ kg de combustível seco];
Mede-se o PCS em laboratório utilizando o Calorímetro descrito anteriormente e o PCI indiretamente por cálculo utilizando a Equação 2.
Como a temperatura dos gases de combustão encontra-se acima de 100°C na saída das máquinas térmicas, a água contida neles se encontra sempre no estado de vapor.
Portanto, deve-se considerar sempre o Poder Calorífico Inferior e não o Superior nos cálculos de eficiência de usinas termelétricas e na comercialização de combustíveis.
Tabela 2. Combustíveis Gasosos
| wdt_ID | Combustível | Densidade [g/m3] | PCS [kWh/kg] | PCI [kWh/kg] |
|---|---|---|---|---|
| 1 | Gás Natural | 777,00 | 15,00 | 13,00 |
| 2 | Hidrogênio | 90,00 | 39,00 | 33,00 |
| 3 | Gás de Refinaria | 1.158,00 | 14,00 | 13,00 |
Tabela 3. Combustíveis Líquidos
| wdt_ID | Combustível | Densidade [g/cm3] | PCS [kcal/kg] | PCI [kcal/kg] |
|---|---|---|---|---|
| 1 | Petróleo Cru | 0,847 | 10.878,00 | 10.195,00 |
| 2 | Gasolina | 0,745 | 11.115,00 | 10.377,00 |
| 3 | Diesel | 0,837 | 10.931,00 | 10.221,00 |
| 4 | Óleo Pesado | 0,991 | 10.082,00 | 9.426,00 |
| 5 | Etanol | 0,789 | 7.129,00 | 6.437,00 |
| 6 | Metanol | 0,794 | 5.466,00 | 4.799,00 |
Tabela 4. Combustíveis sólidos
| wdt_ID | Combustíveis | PCS [kcal/kg] | PCI [kcal/kg] |
|---|---|---|---|
| 1 | Carvão | 5.725,00 | 5.429,00 |
| 3 | Madeira | 4.918,00 | 4.670,00 |
| 4 | Bagaço de cana | 3.906,00 | 3.596,00 |
| 5 | Resíduo florestal | 3.934,00 | 3.679,00 |
| 6 | Coque de Petróleo | 7.478,00 | 7.047,00 |
Temperatura da Chama
A Temperatura da Chama representa outra característica importante dos combustíveis, sendo fundamental para o projeto e dimensionamento de equipamentos e máquinas térmicas.
Calcula-se a temperatura teórica da chama considerando todo o calor resultante da combustão transferido sem perdas para os produtos da combustão. Como denomina-se um processo sem troca de calor de adiabático, a temperatura da chama também se denomina de Temperatura Adiabática da Chama. Na verdade, existem duas temperaturas adiabáticas da chama; uma para combustão a pressão constante e outra para combustão a temperatura constante. 7
Se a mistura ar combustível queima adiabaticamente em pressão constante, a entalpia absoluta dos reagentes no estado inicial permanece igual à entalpia absoluta dos produtos no estado final, de acordo com a Equação 2.
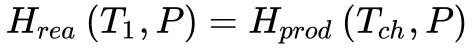
Portanto, a temperatura do estado final será a temperatura adiabática da chama à pressão constante.
Aparentemente simples, a Equação 2 se torna de difícil aplicação prática, porque se desconhece a composição exata dos reagentes e dos produtos da combustão.
De acordo com Garcia, a Equação 3 fornece o valor da temperatura da chama.
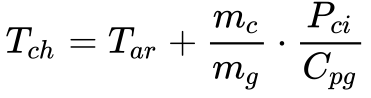
Onde:
-
- Tch é a temperatura da chama [ºK]
- Tar é a temperatura do ar na entrada da combustão [ºK]
- PCI é o poder calorífico inferior [kJ/kg]
- mc é a massa de combustível queimada [kg/s]
- mg é a massa dos gases de combustão [kg/s]
- Cpg calor específico dos gases de combustão [kJ/kg.K]
A Tabela 2 apresenta valores de temperatura de chama obtidas na Wikipedia e outras referências. Os valores apresentados na Wikipedia se referem a valores teóricos de temperaturas de chama considerando temperatura ambiente de 20 oC, pressão de 1 bar e combustão estequiométrica. Por isso, valores diferentes podem ser encontrados na literatura e na prática.
Tabela 2. Temperatura de Chama
| wdt_ID | Substância | Temperatura (C) | Referência |
|---|---|---|---|
| 1 | Hidrogênio | 2.102 | Garcia/CRC |
| 2 | Monoxido de Carbono | 2.468 | Garcia |
| 3 | Metano | 1.918 | Garcia |
| 4 | Etano | 1.949 | Garcia |
| 5 | Propano | 1.967 | Garcia |
| 6 | n-Butano | 1.973 | Garcia |
| 7 | Eteno | 2.343 | Garcia |
| 8 | Propeno | 2.254 | Garcia |
| 9 | Buteno | 2.221 | Garcia |
| 10 | Acetileno | 2.607 | CRC Handbook of Chemistry and Physics (K) |
| 11 | Acetileno | 3.480 | wikipédia ( oxigênio) |
| 12 | Etanol | 2.082 | wikipédia |
| 13 | Gasolina | 2.138 | wikipédia |
| 14 | Metanol | 1.949 | wikipédia |
| 15 | Gas Natural | 1.960 | wikipédia |
| 16 | Madeira | 1.980 | wikipédia |
| 17 | Querosene | 2.093 | wikipédia |
| 18 | Diesel | 2.101 | wikipédia |
| 19 | Oleo Combustível | 2.102 | wikipédia |
| 20 | Carvão | 2.172 | wikipédia |
Referências
- GARCIA, R., Combustíveis e Combustão Industrial, Interciência, 2002.
- Ristinen, Robert, and Jack Kraushaar. “Fossil Fuels.” Energy and the Environment. 2nd ed. John Wiley & Sons, 2006. 365. Print.
- Speight, J. G. The Chemistry and Technology of Petroleum. 3rd ed. New York: Marcel Dekker, 1999. Print.
- The Petroleum Handbook. 6th ed. Amsterdam: Elsevier; 1983. Print.
-
Warnatz, J., and U. Maas. “Introduction.” Combustion Physical and Chemical Fundamentals, Modeling and Simulation, Experiments, Pollutant Formation. 3th ed. Berlin: Springer, 2001. Print.
-
Winterbone, D. E. “Thermodynamics of Combustion.” Advanced Thermodynamics for Engineers. London: Arnold, 1997. Print.
-
Yaws, Carl L. “Enthalpy of Formation.” Chemical Properties Handbook: Physical, Thermodynamic, Environmental, Transport, Safety, and Health Related Properties for Organic and Inorganic Chemicals. New York: McGraw-Hill, 1999. Print.
- Zielenkiewicz, Wojciech, and Eugeniusz Margas. “Classification of Calorimeters.” Theory of Calorimetry. Dordrecht: Kluwer Academic, 2002. Print.
- HAYNES, W.M. (EDITOR), CRC Handbook of Chemistry and Physics, 93a Ed., 2021-2013.
