“Ciência é imaginação numa camisa de força”
Feymann
Introdução
Assim como os artistas conhecem as propriedades e características dos pincéis, tintas, e telas, engenheiros precisam conhecer a estrutura da matéria.
As propriedades macroscópicas dos materiais se classificam em:
-
- Mecânicas;
- Térmicas;
- Elétricas;
- Magnéticas;
- Óticas;
- Químicas;
O conhecimento empírico das propriedades da matéria mostrou uma correlação entre elas, mas materiais diferentes possuem comportamentos distintos.
O uso dos materiais começou empiricamente, mas a ciência se tornou indispensável na ciência dos materiais. Por isso, teoria e prática andam de mãos dadas na ciência dos materiais, um dos pilares da engenharia, conforme mostra a Figura 1.
Os materiais apresentam características e propriedades distintas em decorrência dos diferentes elementos químicos existentes na Tabela Periódica, das possíveis combinações de elementos, das possíveis arrumações dos elementos e das distintas forças atuando nas ligações entre elementos – Figura 2. Esses aspectos caracterizam a estrutura da matéria.
Estrutura da Matéria
Conhecer os elementos básicos da matéria constitui questão fundamental da ciência.
Intuitivamente, o conceito de unidade indivisível de matéria atraiu os cientistas desde a antiguidade, e os filósofos gregos a chamaram de átomo. Contudo, o conhecimento científico da época se mostrou insuficiente para aprofundar o conceito.
Trabalho Proposto
Assista o video e anote as dúvidas surgidas, os conceitos que você desconhecia e os aspectos que você discorda.
Finalmente, responda às seguintes perguntas:
- Qual a motivação dos Alquimistas?
- Qual a importância da Eletrólise na química?
- Como os elementos se formam nas estrelas?
- Por que as estrelas somente são capazes de produzir elementos entre o Hélio e o Ferro?
- Como os elementos mais pesados do que o Ferro foram formados?
- O que é a matéria escura?
- Quais elementos estavam na tabela original e quais foram descobertos depois? 1
- Como e por quem foram descobertos os elementos que estavam faltando na tabela periódica de Dmitri Mendeleev?
- Como a tabela pode ser usada para descobrir novos elementos para ocupar as lacunas?
- Ainda existem lacunas na Tabela Periódica?
- Por que os elementos não podem ser divididos em substâncias mais simples?
- Por que os metais alcalinos reagem com a água?
Elementos Químicos
Apesar de diversos elementos químicos, tais como ouro, prata, estanho, cobre, chumbo e mercúrio, já terem sido descobertos na antiguidade, considera-se a descoberta do Fósforo em 1649 por Henning Brand como a primeira descoberta científica de um elemento químico.
A Química evoluiu com a descoberta de novas substâncias até que Mendeleev propôs o conceito da Tabela Periódica em 1871.
Com a Tabela Periódica, os elementos químicos conhecidos foram agrupados e seu comportamento começou a ser explicado em função de sua posição relativa, que reflete a estrutura do átomo.
Mendeleev organizou empiricamente os elementos químicos através de propriedades macroscópicas, mas desconhecia a estrutura da matéria. Contudo, ele descobriu diversas posições na Tabela sem elementos conhecidos, que a ciência passou a procurar.
Apesar da evolução da ciência, até recentemente existiam elementos da Tabela Periódica ainda não encontrados na terra.
Em 2015, a IUPAC e a IUPAP confirmaram as descobertas dos elementos Nipónio (113), Moscóvio (115), Tenesso (117) e Oganessônio e, finalmente, a Tabela Periódica se completou. Isso ocorreu 144 anos após a Tabela Periódica, 366 anos após a descoberta do Fósforo, e 7 000 anos após a descoberta do Cobre.
O Átomo
Durante muito tempo, os cientistas consideraram os elementos químicos as unidades elementares da matéria e os denominaram de átomos, em homenagem aos gregos.
O Elétron
Em 1897, J.J. Thomson descobriu os elétrons com seu tubo de raios catódicos, destruiu o conceito de indivisibilidade do átomo, e deu origem à Eletricidade. Porém, a descoberta da divisibilidade do átomo provocou a necessidade de nova teoria para a estrutura da matéria.
O Núcleo do Átomo
Em 1911 a partir de experiências com partículas alfa, Rutherford concluiu que:
-
- a matéria tinha muito espaço vazio;
- existia um núcleo pequeno e denso;
- este núcleo possuía carga elétrica positiva.
Em seguida, Bohr propôs um modelo atômico onde cargas negativas, chamadas de Elétrons, orbitavam um núcleo positivo. Este modelo se mostrou atraente para explicar as descobertas de Rutherford, parecia com o modelo planetário, mas apresentava uma inconsistência eletromagnética.
Cargas elétricas em trajetórias não lineares, isto é, com aceleração, emitem energia eletromagnética e, consequentemente, perderiam velocidade e terminariam se chocando com o núcleo. Portanto, de acordo com essa teoria, a matéria não poderia existir no universo.
Como o eletromagnetismo se encontra correto e a matéria existe, o modelo atômico estava errado. Para resolver esta questão, Bohr propôs que os elétrons orbitassem em trajetórias fixas sem perda de energia. Este postulado deu início à Física Quântica.
O Nêutron
Estes conceitos sobreviveram até 1932 quando James Chadwick descobriu o Nêutron.
Atualmente, sabe-se que os átomos, que deveriam ser indivisíveis, são formados por elétrons orbitando um núcleo, formado por Núcleons; os Prótons e os Nêutrons.
Os Núcleons e o Elétron foram considerados as partículas fundamentais da matéria até a década de 1960.
Partículas Subatômicas
Atualmente, considera-se os Nucleons partículas subatômicas, mas não elementares, e o Elétron permanece como partícula elementar, conforme mostra a Figura 3.
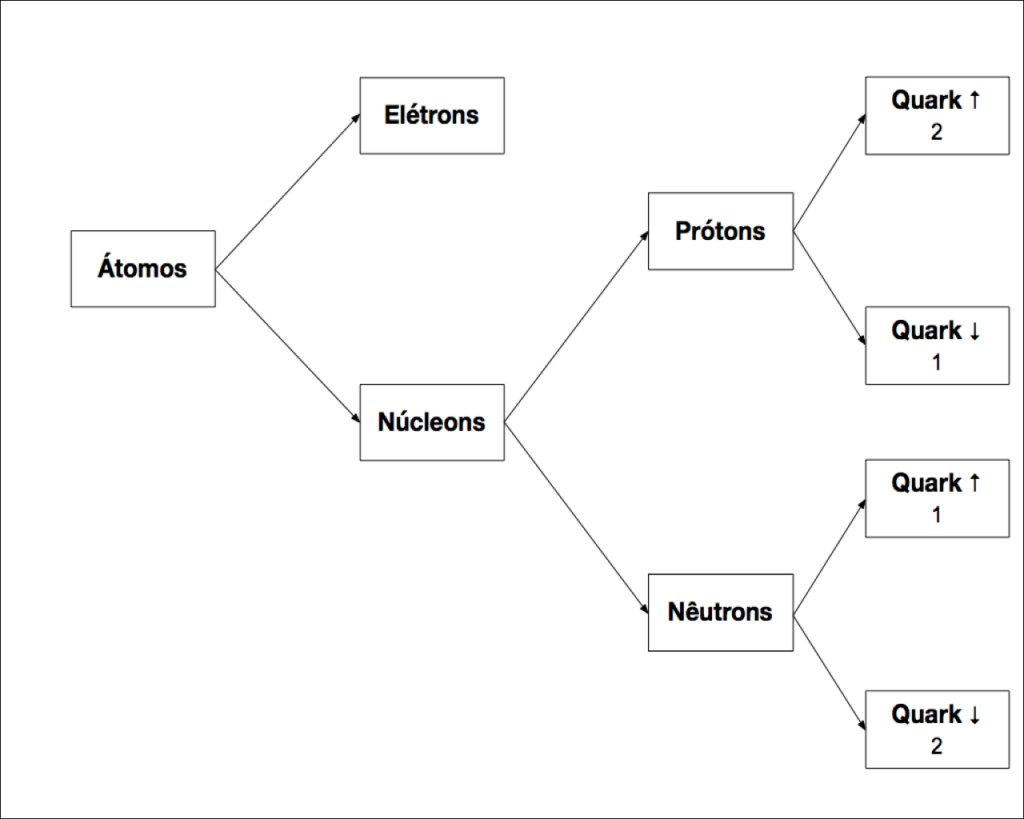
Em 1964, a indivisibilidade dos Nucleons foi quebrada. Prótons e Nêutrons deixaram de ser partículas elementares e se tornaram partículas subatômicas.
A Física caminhou muito desde então e criou o Modelo Padrão, atualmente aceito com restrições pela comunidade científica. Este modelo descreve todos os fenômenos físicos, exceto a gravidade2. Por isso, a ciência ainda não o considera o modelo final.
Modelo Padrão
O Modelo Padrão explica as seguintes forças fundamentais da física:
-
- Força Eletromagnética;
- Força Forte;
- Força Fraca.
A Figura 4 apresenta um resumo das partículas elementares do Modelo Padrão e sua relação com os Nucleons.
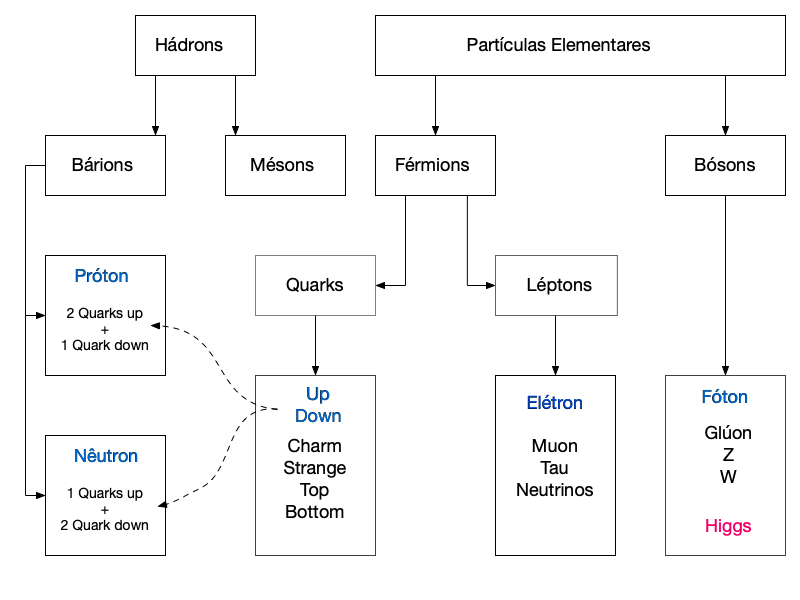
As partículas em azul consistem nas mais importantes para o estudo de materiais até agora.
As antipartículas3 elementares não se encontram na figura para facilitar sua leitura e porque não fazem parte da matéria no universo conhecido.
Classificação das Partículas Elementares
Existem dois grupos de partículas elementares: Férmions e Bósons.
Férmions
Férmions são partículas com spin 1/2, obedecem ao princípio de exclusão de Pauli e receberam este nome em homenagem ao físico Enrico Fermi.
Segundo o princípio de exclusão de Pauli, partículas de mesmo spin não podem ocupar o mesmo nível energético. Este princípio, familiar aos que estudaram química básica com relação aos elétrons, foi apenas ampliado para outros elementos.
Férmions podem ser partículas ou átomos que obedecem a distribuição estatística Fermi-Dirac e, dentre as partículas elementares, se classificam em Quarks e Leptons.
Quarks
Quarks são as partículas elementares constituintes dos Hádrons. Quarks nunca foram encontrados ou observados sozinhos, mas possuem carga elétrica, massa, spin e outras novas características denominadas de cor, up/down, charm/strange e top/down.
Além disso todas as forças fundamentais (Gravidade, Eletromagnetismo, Força Forte e Força Fraca) os afetam. Sua carga elétrica não é unitária assume os valores 2/3 (up, charm e top) e – 1/3(down, strange e bottom). Isto explica a carga elétrica dos prótons e nêutrons.
Leptons
Leptons são partículas elementares com spin igual a 1/2 que podem ter carga elétrica igual a 1, 0 ou -1. O Elétron consiste no Lepton mais famoso e importante, e apenas as forças eletromagnética e fraca os afetam.
Bósons
Bósons são partículas que possuem spin inteiro e, por isso, não seguem o princípio de exclusão de Pauli.
Por exemplo, o Fóton consiste no Bóson mais importante para a engenharia elétrica, mas o Bóson de Higgs se tornou o mais famoso em decorrência de sua descoberta em março de 2013 no CERN.
Os Bósons seguem a distribuição estatística de Bose-Einstein. Além disso, diversos Bósons podem ocupar o mesmo nível energético. Exemplos: Mesons e Nucleons estáveis com número de massa par. 4
Trabalho proposto
Identifique os elementos da Tabela Periódica com número de massa par.
Os Bósons são responsáveis pelas forças fundamentais sendo:
-
- os Fótons responsáveis pela força eletromagnética;
- os Bósons W+, W- e Z responsáveis pela força fraca;
- os Glúons responsáveis pela força forte.
Hádrons
Hádrons são sistemas com mais de um Quark e se subdividem em Bárions e Mésons.
Mésons
Mésons são partículas subatômicas instáveis formadas por um quark e um antiquark.
Bárions
Por sua vez, os Bárions são partículas subatômicas formadas por três quarks que se unem pela força forte e se tornaram os elementos básicos da matéria. Por serem formados por Férmions, eles seguem o princípio de exclusão de Pauli.
Será que a ciência encontrou finalmente as tão procuradas unidades indivisíveis da matéria? A única certeza é que não temos certeza. A Física continua evoluindo e a cada dia surgem novas notícias de descobertas.
Como isto tudo afeta a engenharia? No curto prazo, tudo continua na mesma.
Na falta de novas teorias, continua-se utilizando as existentes e o conhecimento empírico obtido a partir de experiências de laboratório.
Contudo, a cada nova descoberta da Física, a ciência dos materiais evolui de forma explosiva e os engenheiros precisam se adaptar rapidamente.
Por isso, torna-se cada vez mais importante que engenheiros se atualizem com Física e Química para que possam utilizar da melhor maneira possível os materiais disponíveis. Em particular, não há mais como fugir da Física Quântica porque ela se encontra por trás de toda a engenharia elétrica.
Combinações de Elementos Básicos
Considerando que existem 1185 átomos conhecidos, existem infinitas combinações para formar moléculas.
Por exemplo, sem considerar restrições químicas para combinações de átomos, a combinação de 98 átomos diferentes dois a dois forneceria 4 753 moléculas distintas.
Cada uma dessas inumeráveis moléculas forma uma substância elementar que pode se combinar em compostos e misturas. Portanto, as possibilidades de materiais diferentes se tornam incalculáveis.
O tamanho das moléculas pode ser da ordem de grandeza de um átomo, mas não apresenta limite superior porque os cientistas criam moléculas cada vez maiores.
A Figura 5 mostra as possibilidades de combinações de átomos, moléculas, compostos, misturas, soluções e ligas.
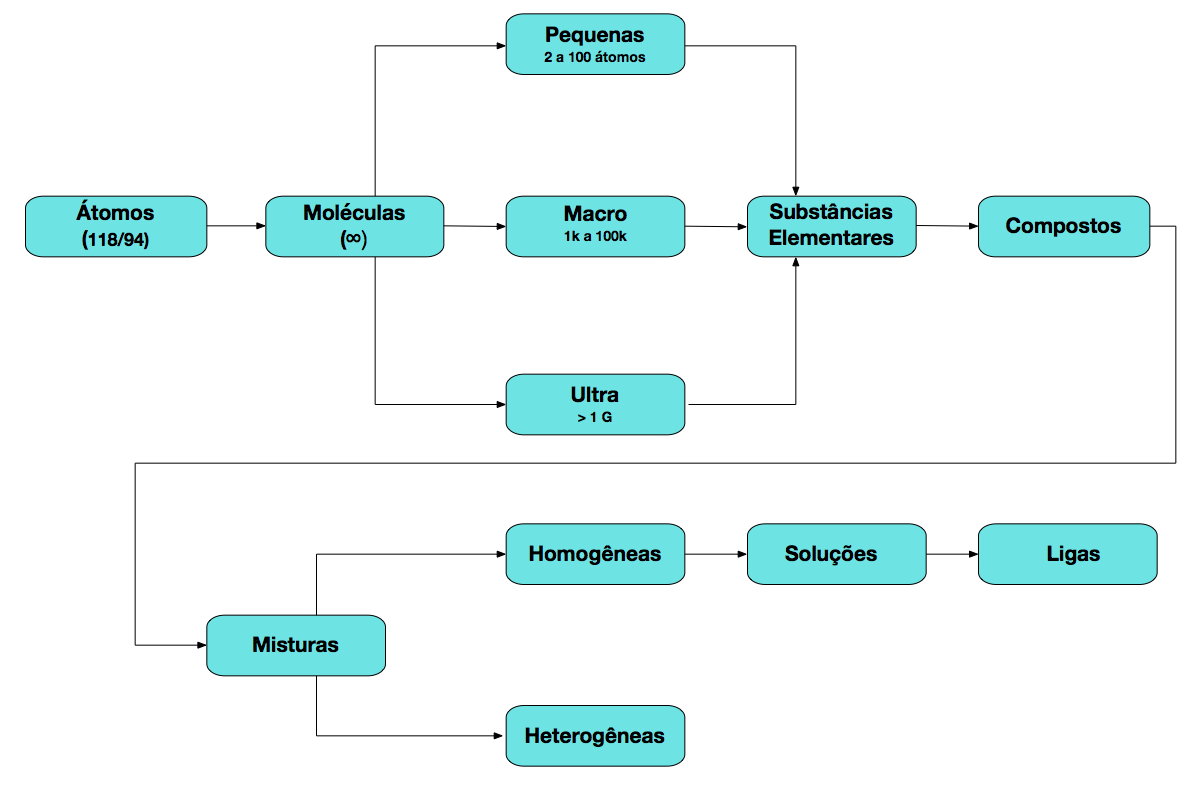
Tamanho dos Átomos e Moléculas
Átomos não podem ser medidos precisamente devido à incerteza da posição dos elétrons conforme previsto na Mecânica Quântica.
Contudo, do ponto de vista prático, define-se o tamanho do átomo como sendo a distância entre seu núcleo e elétron mais externo. Evidentemente, esta distância varia com a proximidade de outros átomos e/ou a presença de campos elétricos e magnéticos.
Por exemplo, a Tabela Periódica Ptable fornece quatro informações sobre o raio dos átomos: calculado, empírico, covalente, e Van der Walls, conforme mostra a Figura 6.
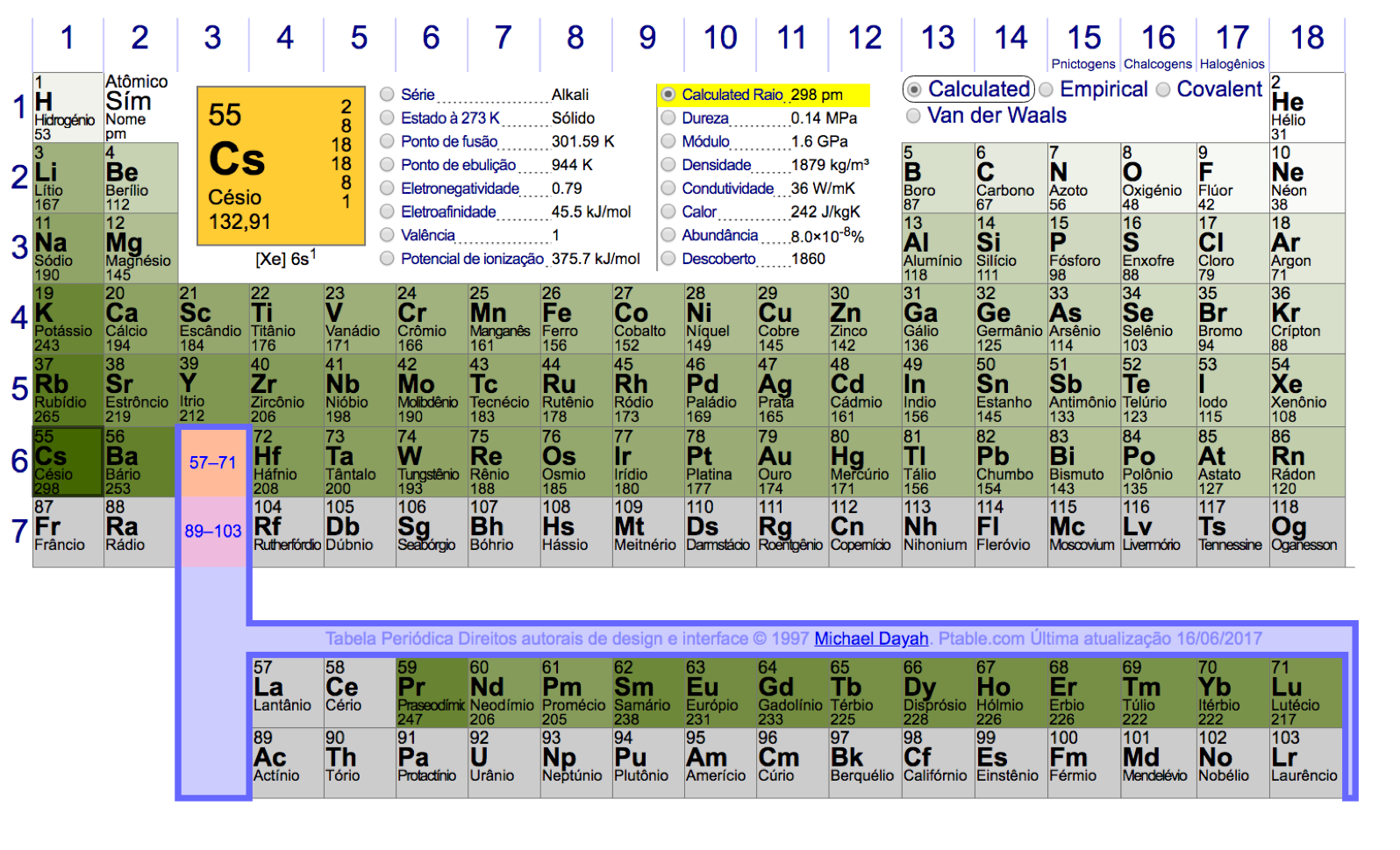
O valor calculado se baseia na teoria disponível, o valor empírico se fundamenta em métodos experimentais e os demais dependem da força de ligação química estabelecida pelo átomo para formar moléculas; ligação Covalente ou Van der Waals.
Analisando os dados da Figura 6, observa-se que os Metais Alcalinos6 apresentam os maiores raios e os Gases Nobres7 os menores.
Além disso, o raio atômico aumenta com o aumento das linhas. Por isso, o átomo de maior raio deveria ser o Frâncio e o de menor o Hélio.
Porém, a Tabela não fornece os dados do Frâncio por ser o segundo elemento menos abundante na terra, instável e radioativo.
No entanto, o Césio, o metal alcalino logo acima do Frâncio na Tabela Periódica, possui o maior raio dentre os elementos com esta informação na Ptable.
Qual a explicação para este comportamento?
A resposta se encontra nos orbitais dos elétrons.
Metais Alcalinos possuem apenas um elétron da última camada, que sofre um efeito de repulsão dos demais elétrons das camadas mais internas.
Por isso, quanto maior o número de elétrons nas camadas mais internas, maior será a força de repulsão, e, consequentemente a distância deste elétron em relação ao núcleo.
Como o número de elétrons cresce com o número atômico, o raio dos átomos aumenta com o aumento das linhas na tabela.
Isto demonstra a importância da estrutura atômica nas propriedades dos materiais.
A Figura 7 mostra as dimensões relativas do átomo e do núcleo. Observa-se que o diâmetro do átomo se encontra da ordem de 100 vezes maior do que o diâmetro do núcleo. Isto significa que existe muito espaço vazio dentro dos átomos.

Por sua vez, a Figura 8 indica que substâncias elementares, como o sal de cozinha apresentam distâncias entre moléculas maiores que 1 nm e moléculas distâncias entre 0,1 e 10 nm. Isto comprova a existência de muito espaço vazio no interior da matéria.

Diferentes Forças entre Elementos Básicos
Partículas Elementares se unem em determinadas circunstâncias e seguindo regras estabelecidas para formar partículas subatômicas.
Por sua vez, essas partículas se ligam para formar os átomos obedecendo outras leis e condições.
Finalmente, átomos se associam para formar Moléculas e Substâncias. Estes três níveis de enlaçamento requerem energias e mecanismos físico-químicos distintos.
Por exemplo, a Força Forte mantém os Quarks unidos para formarem Prótons e Nêutrons e os preserva conectados no núcleo dos átomos.
Esta força extremamente poderosa, 137 vezes mais poderosa do que a força eletromagnética, possui um raio de ação muito pequeno.
As ligações químicas; Iônica, Covalente, Metálica, e Van der Walls, fornecem as forças que mantêm os átomos unidos para formar as substâncias.
Finalmente, outras forças mantêm essas moléculas e compostos unidos em líquidos e sólidos.
Independentemente das forças envolvidas, a existência da matéria ocorre em função do equilíbrio entre forças de atração e de repulsão.
Para isso, as cargas elétricas das partículas subatômicas e elementares desempenham papel fundamental.
Todas as forças da natureza apresentam uma intensidade inversamente proporcional à distância. Porém, a taxa de variação da intensidade com a distância depende do tipo de força envolvida e, graças a essas diferenças, a matéria existe de forma estável no universo.
A Equação 1 define a energia total do sistema8 onde forças de atração e repulsão atuam simultaneamente.
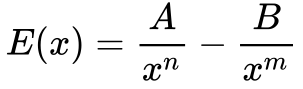
Onde:
-
- E é a energia total do sistema;
- x é a distância entre os elementos do sistema;
- A e B são constantes das forças envolvidas;
- n e m determinam do decrescimento das forças com a distância.
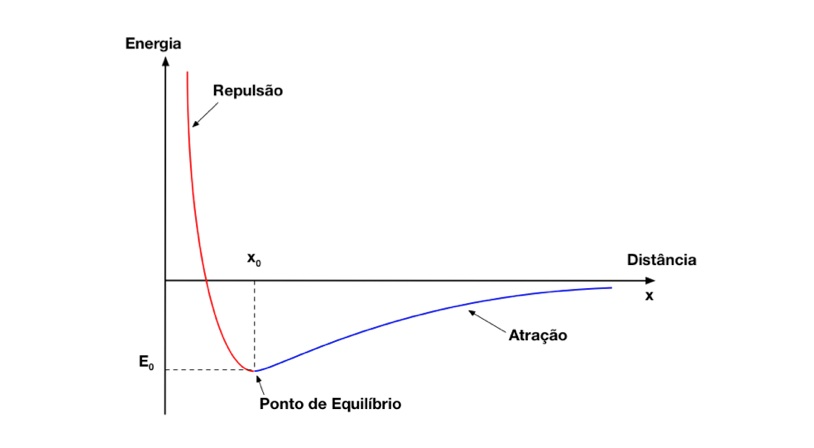
Conforme mostra a Figura 9, o ponto de equilíbrio do sistema ocorre quando as forças se igualam e, consequentemente, a energia encontra seu valor mínimo.
Matematicamente, isto ocorre quando:
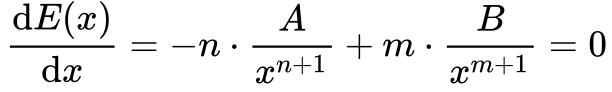
Resolvendo a Equação 2, obtemos os seguintes resultados:
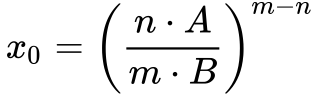
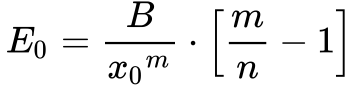
A análise das Equações 3 e 4 permite concluir que:
-
- A ligação entre os elementos somente será estável seja a energia de equilíbrio for negativa;
- m deve ser menor do que n para que a energia de equilíbrio seja negativa;
- As forças envolvidas podem ser quaisquer, mas devem diminuir com a distância entre os elementos.
Força Eletromagnética
A força eletromagnética surgiu implicitamente num artigo de Maxwell publicado em 1865 e explicitamente no artigo de Lorentz publicado em 1895. A equação 5 apresenta a força eletromagnética ou de Lorentz na sua forma completa.
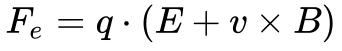
Onde:
-
- Fe é a força eletromagnética [N];
- q é a carga elétrica[C];
- E é o campo elétrico externo[V/m];
- v é a velocidade instantânea da carga[m/s];
- B é a densidade do fluxo magnético[T];
- X é o produto vetorial.
A força eletromagnética se transforma em força eletrostática quando a carga se encontra parada ou quando inexiste campo magnético. Neste caso, a Equação 5 se converte na seguinte equação:
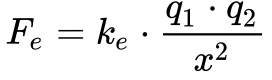
Onde:
-
- Fe é a força eletrostática [N];
- ke é a constante de Coulomb – 8,987 551 7923(14) x 109 [N.m2/C2];
- q é a magnitude das cargas elétricas 1 e 2 [C];
- x é a distância entre as cargas [m].
A Equação 6 mostra que a força eletrostática varia inversamente com o quadrado da distância.
Comparação entre forças
Os físicos utilizam o conceito da constante de estrutura fina para comparar a magnitude das forças da natureza. Esta constante possui diversas interpretações físicas, mas, aqui, ela representa a razão entre a energia eletrostática de repulsão de dois elétrons distantes de x e a energia de um fóton com comprimento de onda igual a 2πx.
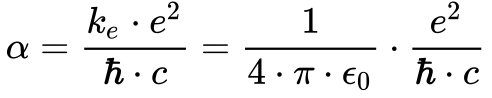
Onde:
-
- α é a constante de estrutura fina [7.297 352 5693(11) x 10-3]9;
- ke é a constante de Coulomb;
- e é a carga do elétron [C];
- h cortado é a constante de Planck dividida por 2π;
- c é a velocidade da luz [2.997 924 58 x 108 m/s].
Este vídeo apresenta uma explicação detalhada da importância da constante de estrutura fina na física.
De acordo com Strassler10, utiliza-se a seguinte relação para definir se determinada força é forte ou fraca.
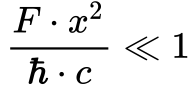
Quando a relação da equação 8 é muito menor do que 1, considera-se a força fraca, mas considera-se força forte se for próxima a 1.
Observa-se que a relação da equação 8 é igual à Constante de Estrutura Fina. Adicionalmente, como esta constante é muito menor do que 1, considera-se a força eletromagnética uma força fraca para todas as distâncias.
Força Fraca
A Força Nuclear Fraca ou Força Fraca é a responsável pelo decaimento radioativo dos átomos e possui papel importante na fissão nuclear e na fusão nuclear.
A Equação 9 apresenta a constante α referente à força fraca.
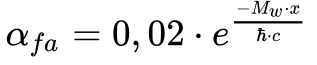
Onde:
-
- Mw é a massa do Bóson W envolvido na ligação [80 GeV/c2];
- x é a distância [m];
- h cortado é a constante de Planck dividida por 2π [1,054 571 81765 x 10 -34 J/Hz];
- c é a velocidade da luz [2,997 924 58 x 108 m/s].
Observa-se que este fator, sempre menor do que 0,02, decresce muito rapidamente com a distância. Isto significa que a Força Fraca é uma força fraca.
Contudo, ela ultrapassa a Força Eletromagnética para distâncias inferiores a 4,4 x10-23 mm e tornar-se 3 vezes mais forte quando a distância tende a zero.
Força Forte
A Força Forte possui comportamento distinto das forças anteriores, sendo seu fator α da ordem de 0,11 a 3×10-18 m.
Isto a coloca distante da classificação de força forte e apenas 10 vezes mais forte do que a Força Eletromagnética nesta faixa de distâncias.
Porém, sua força relativa aumenta com a distância11 e o fator α aumenta para 0,3 para distâncias de 3×10-16 m e ultrapassa o valor de 1 quando atinge distâncias da ordem de grandeza do raio do Próton.
Portanto, a Força Forte em parceria e a Força Eletromagnética mantem Prótons e Nêutrons estáveis e unidos nos núcleos atômicos.
Arrumação dos Elementos Básicos
A arrumação dos elementos básicos da matéria depende das:
-
- Simetrias das moléculas e átomos;
- Forças de atração entre as moléculas e átomos;
- Forças de repulsão entre as moléculas e átomos.
Dependendo deste equilíbrio de forças, os elementos podem estar nos estados:
-
- Sólido;
- Líquido;
- Gasoso.
No estado gasoso, a energia cinética dos elementos supera as forças de atração. Além disso, a pequena quantidade de elementos garante que a distância média entre eles seja maior do que o raio de ação das forças de atração.
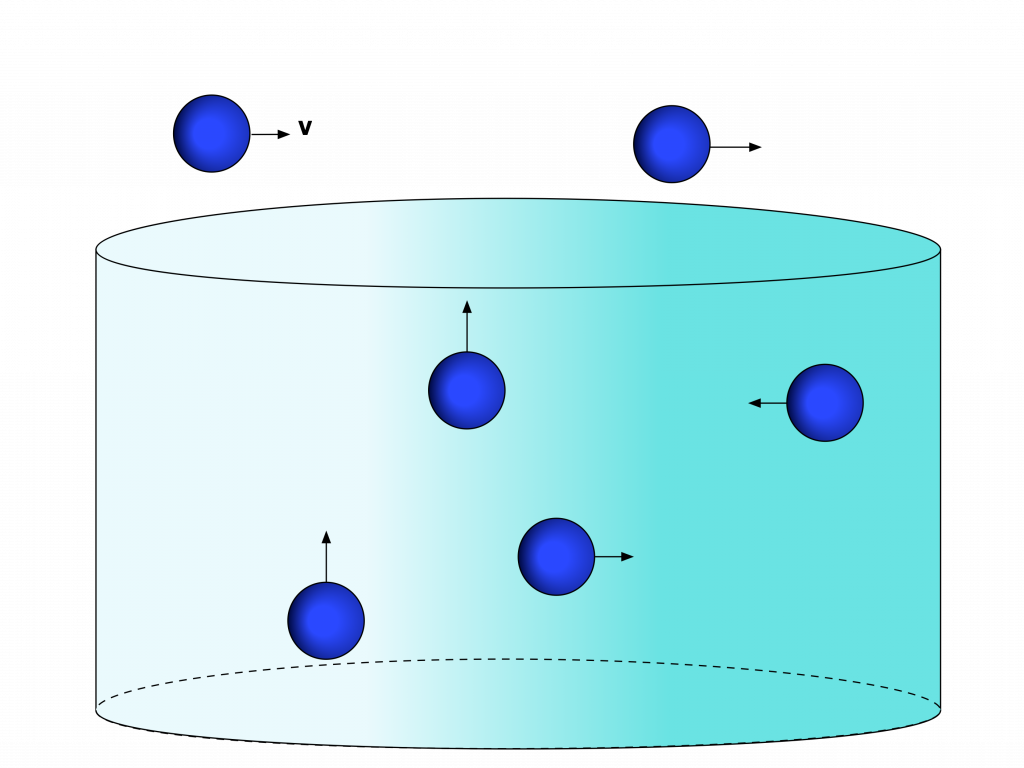
No estado líquido, a energia cinética dos elementos se encontra num valor intermediário, insuficiente para superar totalmente as forças de atração, mas a quantidade de elementos garante que a distância média entre eles seja da ordem de grandeza do raio de ação das forças de atração.
Desta maneira, os elementos ficam ligados dentro do volume que os armazena. Porém, as força de atração são inferiores às forças externas da ordem de grandeza da gravidade.
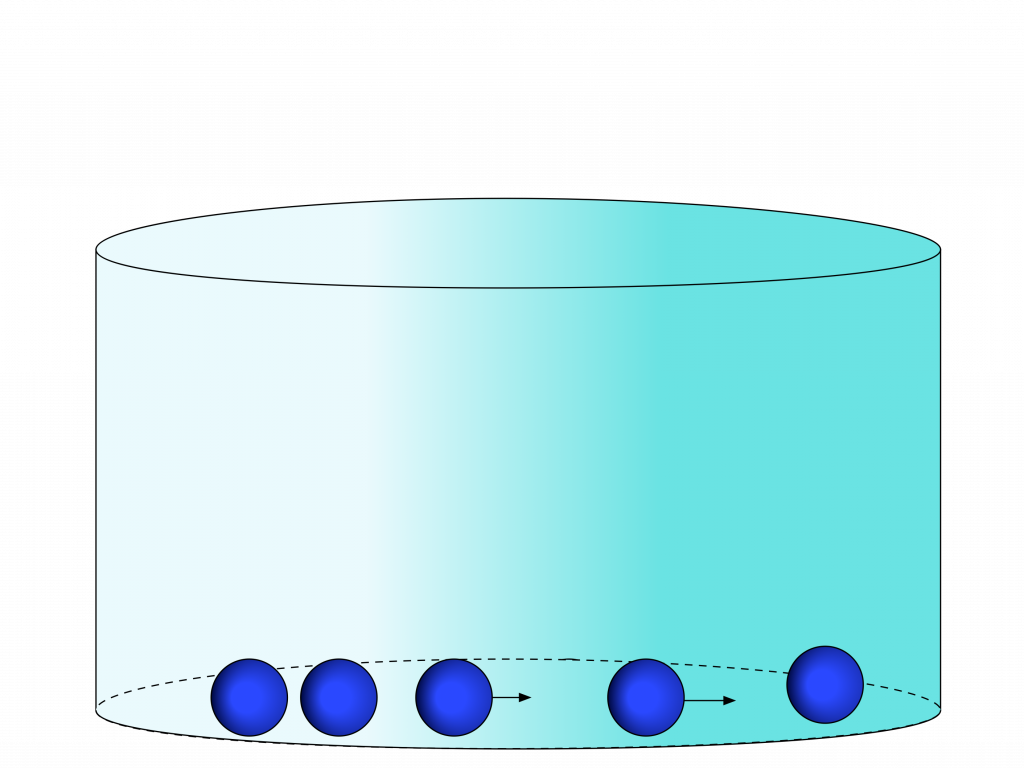
No estado sólido, a energia cinética dos elementos se torna menor do que as forças de atração, e a quantidade de elementos fica maior o suficiente para que a distância média seja da ordem de grandeza do raio de ação das forças de atração.
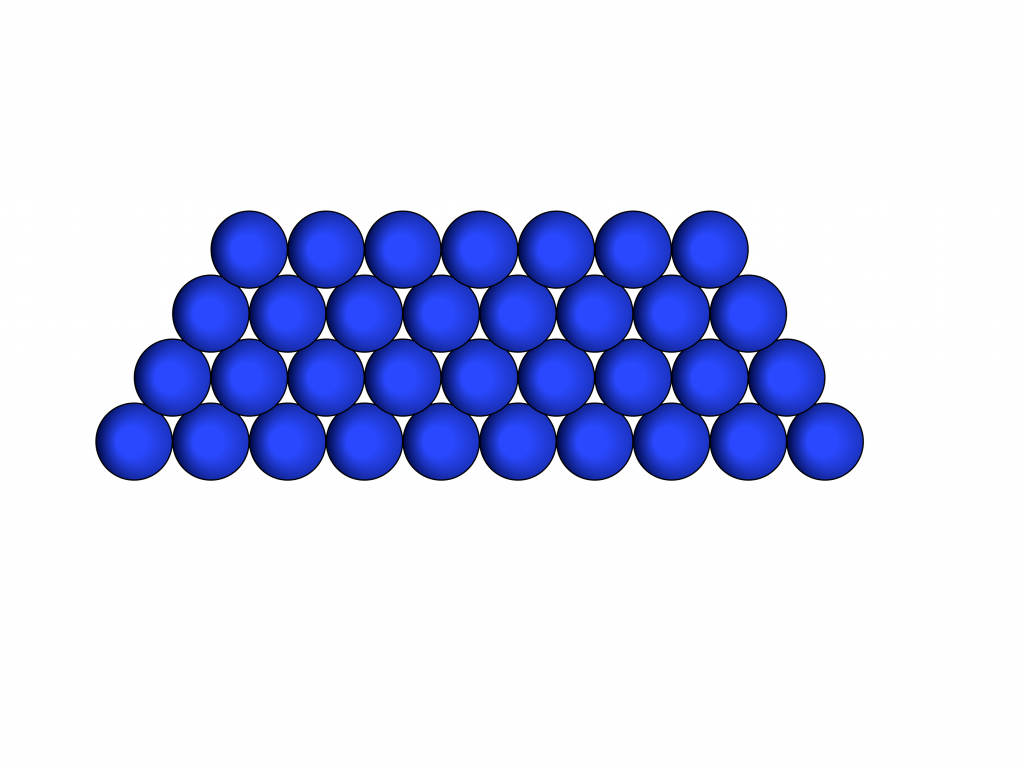
Desta forma os elementos ficam ligados dentro do volume que minimiza a distância entre os elementos independentemente do volume no qual estão inseridos.
Neste caso, as forças de atração são fortes o suficiente para suplantarem a forças externas.
A energia cinética dos elementos consiste no fator fundamental para definir o estado da matéria e esta energia se encontra diretamente relacionada com à temperatura e à pressão.
Os elementos básicos da matéria, átomos e moléculas, possuem simetrias e padrões geométricos distintos. Isto explica as diversas estruturas cristalinas dos materiais sólidos.
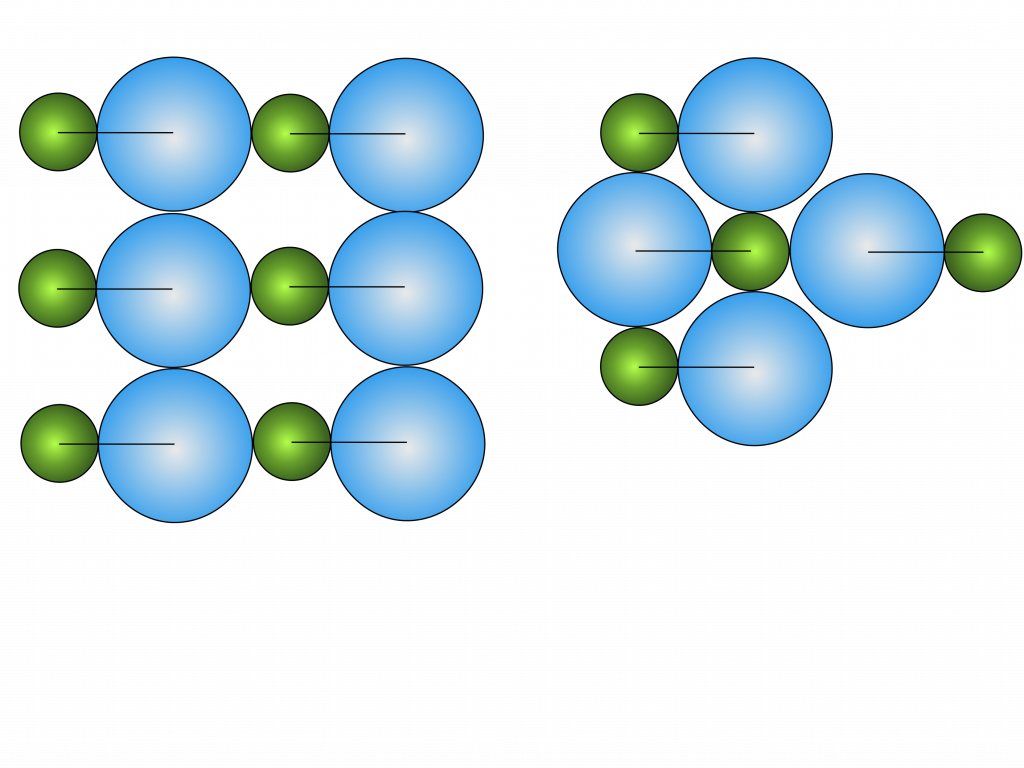
A busca pela configuração de energia mínima determina a estrutura preferencial dos sólidos.
Por exemplo, uma molécula composta de dois átomos de tamanhos diferentes e geometria linear pode solidificar de diversas maneiras, mas a estrutura mais compacta se torna sempre a mais estável.
Os cristais de gelo são um exemplo prático desta questão. Dependendo das condições de solidificação (temperatura, pressão, etc..) os cristais se formam em padrões distintos.

Referências
- ALLCOCK, H. R., Introduction to Materials Chemistry, Wiley, 2008.
- ANDERSON, J.C., et al., Materials Science for Engineers, Taylor & Francis e-Library, 2005.
- ASHCROFT, N.W., MERMIN, N.D., Solid State Physics, Harcourt, 1976.
- BALMER, R.T., Modern Engineering Thermodynamics, Elsevier, 2011.
- BEATY, H.W, FINK, D. G., Standard Handbook for Electrical Engineers, McGraw-Hill, 15th edition, 2007.
- COTTINGHAM, W.N., GREENWOOD, D.A., An Introduction to the Standard Model of Particle Physics, 2 edição, Oxford University Press, 2007.
- MCMAHON, D., Quantum Field Theory Demystified, McGraw-Hill, 2008.
- NEWNHAM, R. E., Properties of Materials – Anisotropy, Symmetry and Structure, Oxford University Press, 2005.
- SOLYMAR, L., WALSH, D., Electrical Properties of Materials, Oxford University Press, 2010.
- YAWS, C.L, Chemical Properties Handbook, McGraw-Hill, 1999.