“A Eletricidade é feita de minúsculas partículas chamadas Elétrons que não podem ser vistas a olho nu, a menos que você esteja bêbado.”
Dave Barry, Humorista Americano
Os Gregos da antiguidade denominaram de átomo a unidade indivisível da matéria, e a química adotou este conceito da designar as memores unidades de substâncias. Mas qual a unidade indivisível da matéria?
No início do século XX, cientistas descobriram, em suas pesquisas relativas à eletricidade e ao eletromagnetismo, que o átomo se compõem de partículas com propriedades elétricas e magnéticas, denominadas de Prótons, Elétrons e Nêutrons.
Mais recentemente, os físicos descobriram que subpartículas, denominadas de Quarks, compõe os Prótons e Nêutrons.
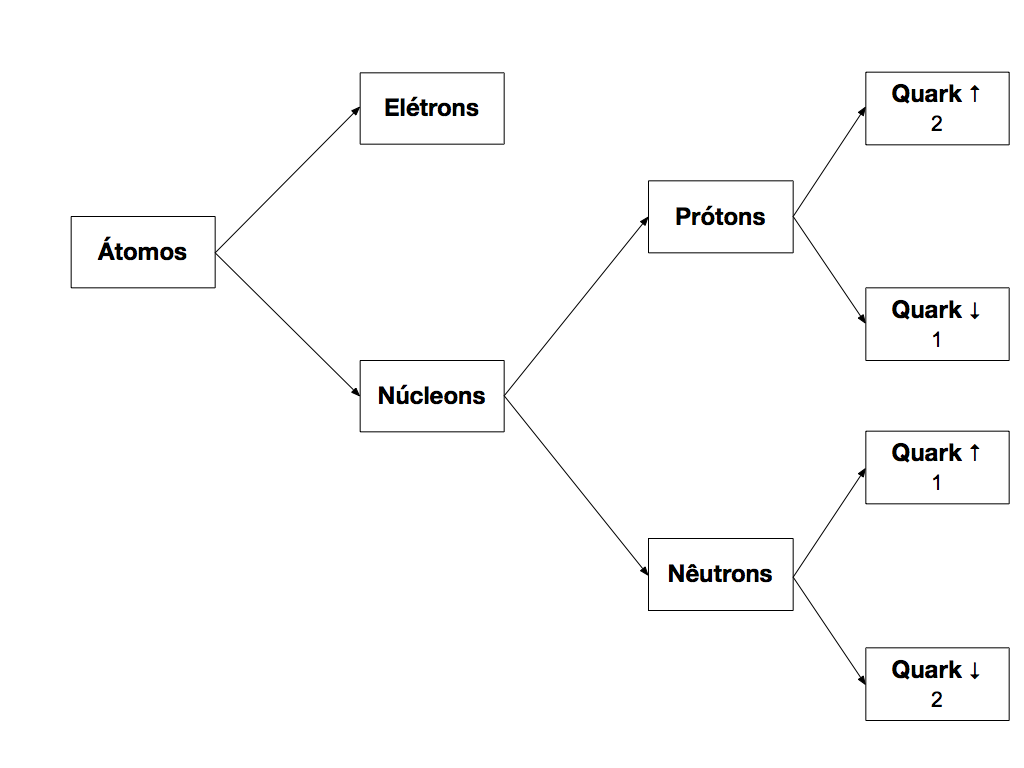
Porém, os elétrons continuam indivisíveis. A Figura 1 apresenta a atual estrutura dos átomos.
Átomos consistem em Elétrons e núcleons. Os Elétrons são as partículas mais externas e formam uma espécie de casca ao redor do núcleo. Por isso, as propriedades dos materiais e a eletricidade estão diretamente relacionadas a esta partícula.
Os núcleons representam os elementos que compõe o núcleo dos átomos e, atualmente, consistem em prótons e nêutrons.
Elétron
O que é o Elétron? Ninguém nunca o viu e podemos apenas detectar sua ação de forma indireta. Ele possui massa, mas também se comporta como onda. Ele foi descoberto em 1897 por Thomson e até o século XX foi considerado a menor unidade indivisível da matéria.
Modelo do Átomo
Em 1911, Rutherford descobriu que os Elétrons estavam localizados a uma certa distância de um núcleo positivamente carregado e propôs a teoria orbital na qual a força de atração eletrostática era compensada pela força centrífuga.
Todavia, essa teoria viola o eletromagnetismo e os cientistas foram obrigados a procurar novas explicações.
Em 1913, Bohr propôs uma solução para essa questão marcando o início da Mecânica Quântica. Porém, somente em 1926, o físico austríaco Erwin Schröndiger publicou sua famosa equação que marcou o início da física quântica.
Contudo, independentemente do que seja o elétron, sem ele não haveria a química, nem a eletricidade, e nem o magnetismo. Portanto, o estudo dos materiais elétricos e magnéticos requer conhecer o elétron e o átomo.
Modelo de Rutherford
Rutherford utilizou os conceitos da mecânica clássica e considerou o elétron em órbita circular estável ao redor do próton. Neste caso, a força centrífuga Fc se encontra em equilíbrio com a força de atração eletrostática Fe, conforme mostra a Figura 3.
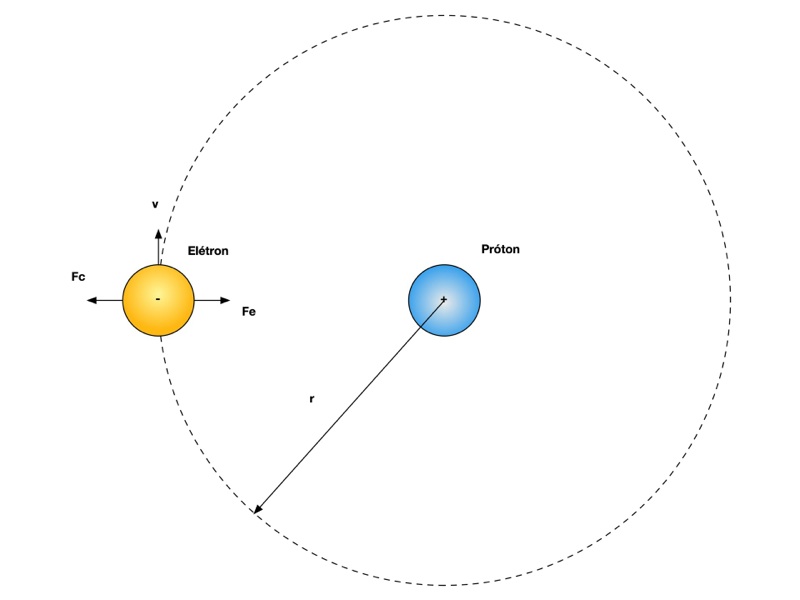
A Equação 1 fornece a força de atração eletrostática e a Equação 2 a força de repulsão centrípeta.
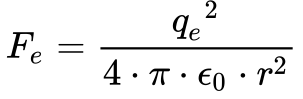
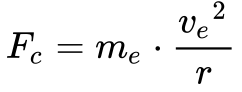
Considerando o sistema em equilíbrio, as forças devem se igualar. Fazendo Fe igual a Fc, a Eq. 3 fornece a velocidade do elétron neste modelo.
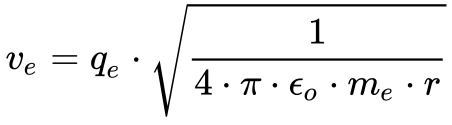
Onde:
Exercício Proposto
Estime a velocidade do elétron no átomo de hidrogênio utilizando a equação 3 e compare com a velocidade da luz.4
Porém, de acordo com a Fórmula de Liénard -Eq.45, toda partícula carregada e sujeita à aceleração emite energia.
Além disso, esta emissão aumenta com o aumento da velocidade e independe do tipo de órbita da partícula de acordo com a Equação 4.
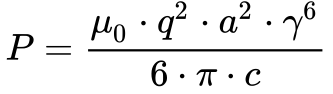
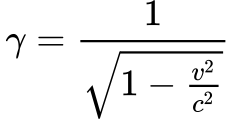
-
- P é a potência radiada pela partícula carregada;
- q é a carga elétrica;
- v é a velocidade da partícula;
- a é a aceleração da partícula;
- c é a velocidade da luz;
- μ0 é a permeabilidade do vácuo.
Portanto, sem outra fonte externa de energia, o elétron seria atraído para o núcleo porque sua velocidade diminuiria devido à emissão de energia.
Portanto, a física classica se mostrou incapaz de representar o átomo.
Emissão Atômica
Paralelamente, experiências com descargas elétricas em gases constataram a emissão de luz com padrões de cor diferentes para cada elemento químico.
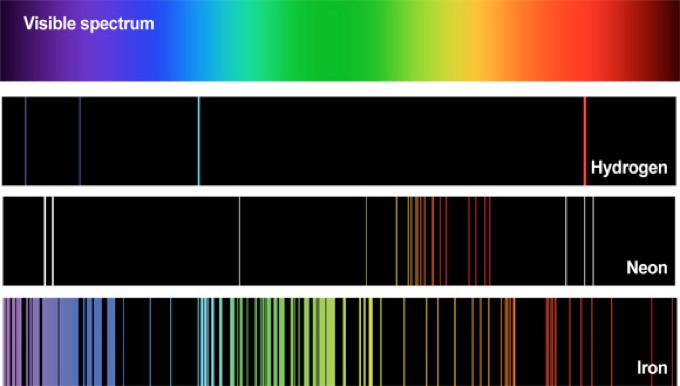
O hidrogênio, o átomo mais simples, se transformou em fonte de estudo para aprofundar o conhecimento da estrutura da matéria e a Fig. 5 revela que o espectro de emissão do Hidrogênio ultrapassa o espectro visível.

Estes resultados experimentais desconcertaram a comunidade científica da época porque nenhuma teoria havia previsto este comportamento.
Rydberg, físico sueco, encontrou no final do século XIX uma expressão empírica que aproximava o comportamento do Hidrogênio, conhecida como a Fórmula de Rydberg.
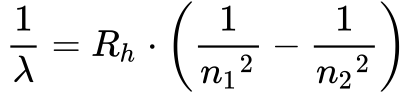
Onde:
O padrão no espectro de emissão funciona como uma impressão digital dos átomos e deu origem à espectroscopia.
Esta técnica permite identificar a composição química de estrelas e materiais.
Por exemplo, o gás nobre Hélio foi descoberto a partir da análise da luz do sol utilizando esta técnica durante a eclipse do sol em 1868. Até então, ninguém havia detectado esse gás na terra.
A Equação 6 revelou o conceito da quantificação das frequências emitidas muito antes de se pensar em mecânica quântica.
Este foi mais um exemplo do fascinante mundo da física experimental sugerindo teorias nunca vislumbradas anteriormente.
As fórmulas empíricas de Rydberg e Balmer, apesar de úteis na prática, são aproximações matemáticas de experimentos e não uma teoria.
A partir deste ponto, surgiu a Física Quântica e apenas ela consegue explicar esses experimentos e as propriedades dos materiais.