Introdução
Combust�vel � qualquer subst�ncia cuja rea��o qu�mica seja exot�rmica.
Entretanto, as condi��es de pre�o, de disponibilidade na natureza ou de processo de fabrica��o em quantidade comercial limitam o n�mero de combust�veis usados na geração de energia elétrica.
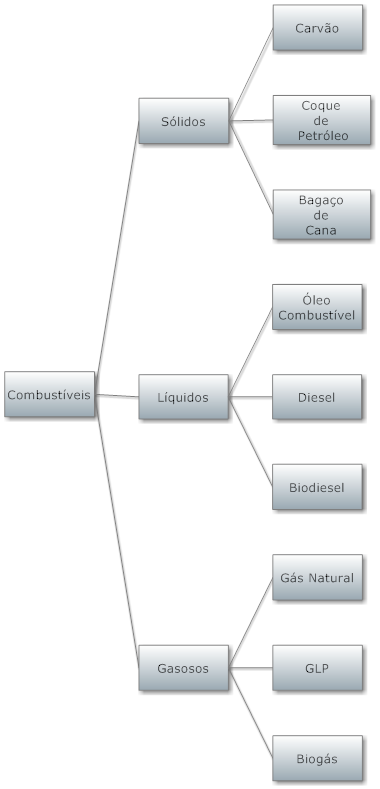
Tendo por base o seu estado f�sico nas condições ambientes, eles são classificados de acordo com a figura abaixo. Esta lista não é definitiva porque novos combustíveis deverão aparecer.
É importante observar que para todos os estados físicos já existem combustíveis renováveis no mercado.
Propriedades Básicas dos Combustíveis
As propriedades dos combustíveis são:
- Poder Calorífico;
- Temperatura da Chama;
Poder Calor�fico
A principal caracter�stica de qualquer combust�vel � gerar energia, normalmente na forma de calor.
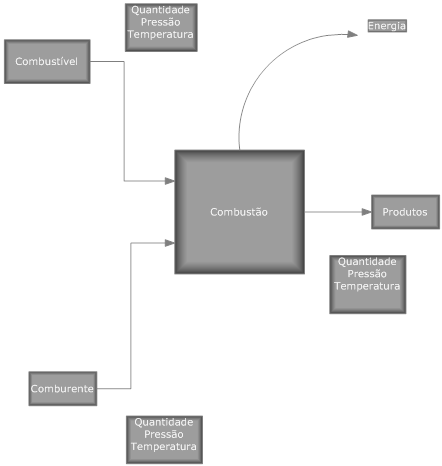
Considerando que uma reação química ocorre dentro de um volume de controle, figura abaixo, sem a realização de trabalho nem variações de energia cinética e potencial, a energia liberada pela reação será dada por:
![]() (1)
(1)
Onde:
- Q é a energia liberada pela combustão;
- Hp é a entalpia dos produtos da combustão;
- Hr é a entalpia dos reagentes da combustão.
Se os reagentes são estáveis e a reação química ocorre em condições de temperatura e pressão constantes, esta variação de entalpias é denominada de entalpia de formação.
As entalpias de formação podem ser positivas ou negativas.
Substâncias com entalpia de formação positiva necessitam de energia para serem formadas - reações endotérmicas.
Por outro lado, substâncias com entalpia de formação negativa liberam energia quando formadas - reações exotérmicas.
Quando a reação química em questão é uma combustão completa, a temperatura e pressão constantes, a variação de entalpia é chamada de entalpia de combustão.
Se os produtos da combustão contém água no estado líquido, a entalpia de combustão é chamada de Poder Calorífico Superior - PCS.
Por outro lado, se a água encontra-se em estado gasoso, a entalpia de combustão é chamada de Poder Calorífico Inferior - PCI.
A diferença entre estes valores é igual ao calor de vaporização em condições padrão.
Como na prática os produtos e reagentes são formados por diversas substâncias a diferentes temperaturas é preciso considerar a energia gasta para elevar a temperatura epressão dos reagentes e/ou dos produtos.
Para isso, utilizando-se o conceito de energia interna, o poder calorífico passa a ser a variação da energia interna do sistema.
Considerando que a energia interna é dada por:
![]()
E que os gases envolvidos na combustão são ideais, teremos que:
![]()
Finalmente, a equação(1) pode ser escrita da seguinte maneira:
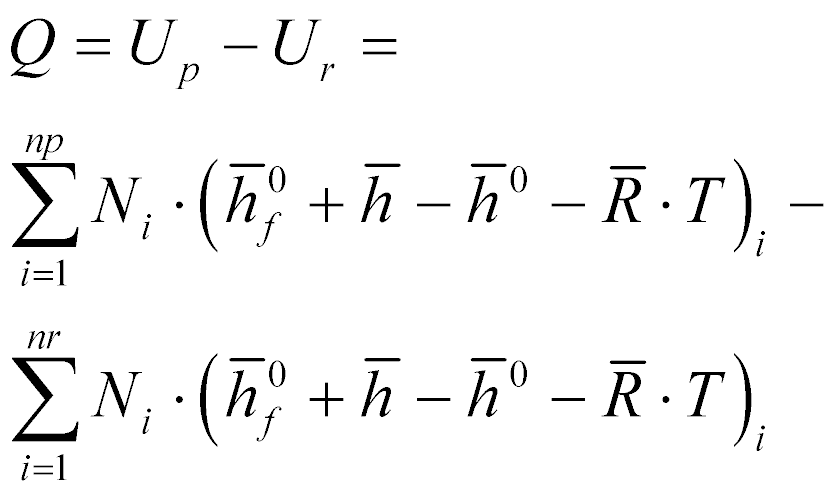
Onde:
- U é a energia interna;
- N é a quantidade de moles da substância i;
- h é a entalpia;
- T é a temperatura
No caso de sólidos, líquidos e gases com calor específico constante, podemos utilizar a seguimte relação:
![]()
Nos casos em que o calor espec�fico dos gases não pode ser considerado constante, deve-se utilizar valores obtidos a partir de tabelas para calcular este fator.
Portanto, o poder calorífico é a quantidade de energia, possível de ser liberada pela combustão de determinado combustível em condições estequiométricas, por unidade de massa.
Conforme mostra a Tabela em anexo, a substância química com maior poder calor�fico � o hidrog�nio, seguido pelo metano, propano, carbono, etanol e metanol.
O carbono, que � o elemento b�sico do carv�o, apresenta o menor poder calor�fico.
Por isso, os combust�veis derivados de petr�leo substitu�ram o carv�o ap�s a revolu��o industrial.
É importante observar que, na prática, existem duas fontes de água no processo de combustão: os átomos de hidrogênio existente nas moléculas do combustível e as moléculas de água misturadas ao combustível e ao ar.
Para levar isto em consideração, de acordo com Garcia, o PCI pode ser calculado a partir do PCS através da seguinte expressão: �
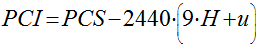
Onde:
- PCI � o Poder Calor�fico Inferior [kj/kg];
- PCS � o Poder Calor�fico Superior [kj/kg];
- H � o teor de hidrog�nio no combust�vel [kg/kg em base seca];
- u � o teor de umidade do combust�vel [kg de �gua/ kg de combust�vel seco];
O Poder Calor�fico Superior � normalmente medido em laborat�rio e o PCI inferior � obtido indiretamente por cálculo.
Como a temperatura dos gases de combust�o � muito elevada nas m�quinas t�rmicas, a �gua contida neles se encontra sempre no estado de vapor.
Portanto, deve-se considerar sempre o poder calor�fico inferior e n�o o superior nos cálculos de eficiência de usinas termelétricas e na comercialização de combustíveis.
Temperatura da Chama
Outra caracter�stica importante dos combust�veis � a temperatura da combust�o.
Este dado � fundamental para o projeto e dimensionamento de equipamentos e m�quinas t�rmicas.
A temperatura te�rica da chama � calculada considerando que todo o calor resultante da combust�o � transferida sem perdas para os produtos da combust�o.
Como um processo sem troca de calor � denominado de adiab�tico, a temperatura da chama tamb�m � denominada de temperatura adiab�tica de chama.
Na verdade existem duas temperaturas adiab�ticas da chama; uma para combust�o a press�o constante e outra para combust�o a temperatura constante.
Se a mistura ar combust�vel queima adiabaticamente em press�o constante, a entalpia absoluta dos reagentes no estado inicial � igual � entalpia absoluta dos produtos no estado final, de acordo com a express�o abaixo:
![]()
Portanto, a temperatura do estado final ser� a temperatura adiab�tica da chama � press�o constante.
Teoricamente, a defini��o � simples no entanto utiliz�-la na pr�tica requer o conhecimento da composi��o dos reagentes e dos produtos.
De acordo com Garcia, fazendo algumas simplifica��es, a temperatura de chama pode ser dada por: �
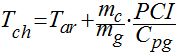
Onde:
- Tch � a temperatura da chama [�K];
- Tar � a temperatura do ar na entrada da combust�o [�K]
- PCI � o poder calor�fico inferior [kJ/kg];
- mc � a massa de combust�vel queimada [kg/s]
- mg � a massa dos gases de combust�o [kg/s]
- Cpg calor espec�fico dos gases de combust�o [kJ/kg.K]
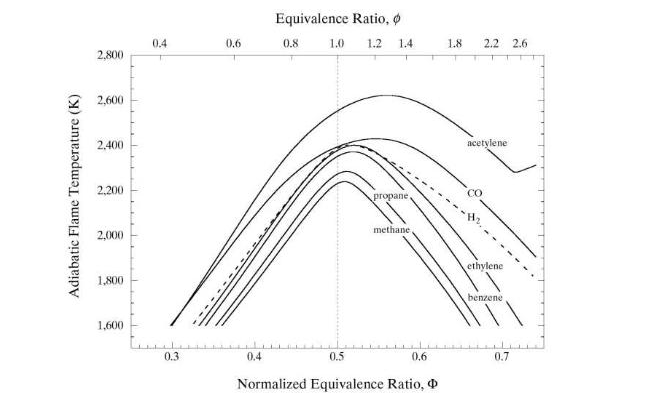
A figura abaixo, apresenta a variação da temperatura adiabática da chama para diversos combustíveis em função da relação combustível-comburente normalizada.
Observa-se que o acetileno apresenta a maior temperatura adiabática de chama. Por isso, este gás é muito utilizado na prática em maçaricos.
Por outro lado, o metano possui uma temperatura de chama menor do que a do propano.
De acordo com Chaw, o parâmetro que mais influencia a temperatura de chama é a relação entre número de moléculas de Carbono e o número de moléculas de Hidrogênio (C/H).
Quanto maior a relação C/H maior será a temperatura adiabática da chama.
Aparentemente, esta conclusão não faz sentido porque a temperatura adiabática de chama do hidrogênio é uma das maiores apresentadas na figura.
Contudo, de acordo com Chaw, esta relação ocorre devido a três fatores:
- Maior energia nas ligações duplas e triplas de carbono que existem nos hidrocarbonetos mais pesados;
- O menor número relativo de átomos de hidrogênio que serão transformados em água que absorve calor na vaporização;
- Necessidade de aquecer o nitrogênio do ar.