O Calor Específico, grandeza intrínseca, relaciona o fluxo de energia com a variação de temperatura nos materiais e representa a capacidade dos materiais armazenarem energia térmica.
Energia Interna
A primeira Lei da Termodinâmica associa a Variação da Energia Interna (dU) com a Variação de Calor (δQ), com a Pressão (p) e com a variação de volume (dV) da seguinte maneira:
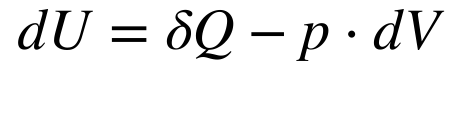
Entalpia
Por sua vez, define-se a Entalpia – H – como sendo a soma da Energia Interna com o produto da pressão pelo volume do sistema. Consequentemente, a Entalpia e sua derivada são dadas por:
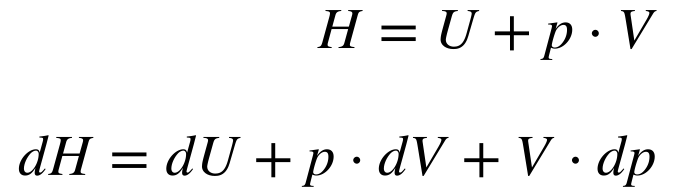
Rearrumando as equações 1 e 2, a variação de calor pode ser definida em função do volume ou em função da pressão de acordo a equação 3.
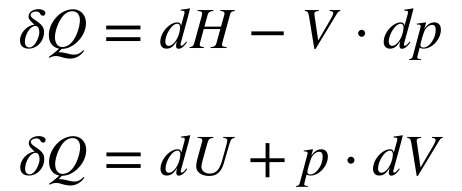
Capacidade Térmica
Definindo Capacidade Térmica (C) como a relação entre a Variação de Calor e a Variação de Temperatura, a equação 3 pode ser escrita da seguinte maneira:
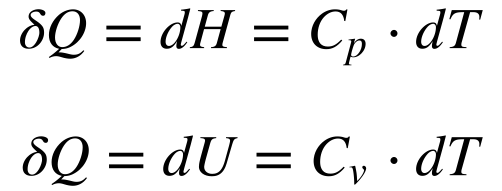
Onde:
-
- Cp é a Capacidade Térmica à pressão constante (dp=0);
- Cv é a Capacidade Térmica a volume constante (dv=0).
Observa-se que ambas são grandezas extrínsecas.
Calor Específico
Obtém-se a grandeza intrínseca associada à Capacidade Térmica, denominada de Calor Específico, dividindo a Capacidade Térmica pela massa. Normalmente, utiliza-se o Calor Específico dos líquidos e sólidos à pressão constante e a dos gases a volume constante.
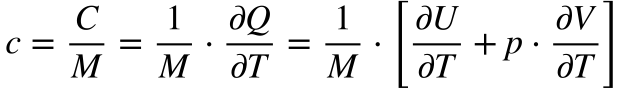
A Equação 6 define o Calor Específico a Pressão Constante e a Equação 7 o Calor Específico a Volume Constante.
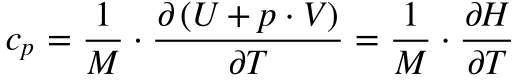
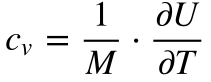
Onde:
-
- C é a Capacidade Térmica [J/K];
- c é o Calor Específico [J/kg/K] ou [J/mol/K];
- Q é o Calor [J];
- T é a Temperatura [K] ou [°C];
- U é a Energia Interna [J];
- p é a Pressão [Pa];
- V é o Volume [m3];
- H é a Entalpia [J];
- M é a Massa [kg] ou [mol].
A figura abaixo mostra a variação do Calor Específico em função da temperatura para diferentes materiais. Observa-se que ambos ( Cp e Cv) aumentam com a temperatura a partir do zero absoluto, mas passam a ter comportamento distinto a partir da temperatura de vaporização.
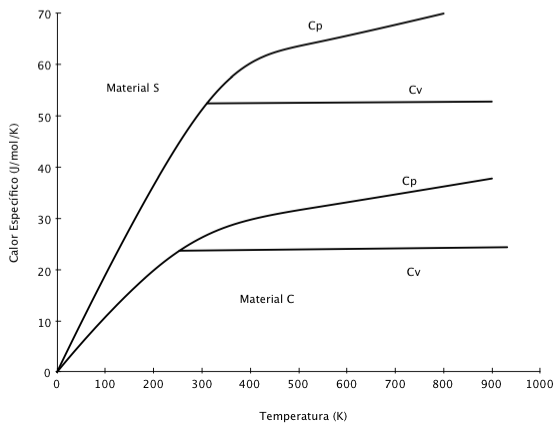
Para gases ideais, a Equação 6 fornece a relação entre os dois valores de calor específico.
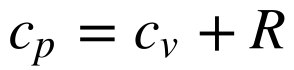
Na prática, a variação do calor específico com a temperatura pode ser aproximada por polinômios de quarta ordem, conforme a expressão:
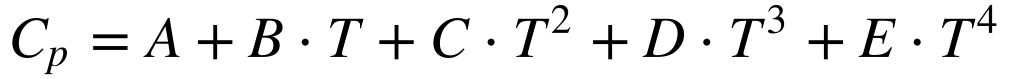
Para sólidos, a aproximação necessita apenas dos termos até segundo grau.
Calor Específico dos Sólidos - Cp
Cp [J/mol/K], T[K]
Fórmula A B C Tmin
(K)Tmax
(K)Cp
(@25 oC)
Ag 23,7 5,0e-3 2,8e-7 203 925 25,24
Al 19,1 1,6e-2 -5,1e-7 205 873 23,70
C -0,8 3,5e-2 -1,3e-5 200 1100 8,40
CO2 41,2 3,1e-2 6,4e-5 150 210 ---
Cu 22,0 8,8e-3 -1,1e-6 373 1273 ---
H2O 9,7 7,5e-2 -1,6e-5 150 273 ----
NaCl 41,3 3,4e-2 1,4e-5 200 1074 50,10
Yaws, Carl L. "Heat Capacity of Solids." Chemical Properties Handbook: Physical, Thermodynamic, Environmental, Transport, Safety, and Health Related Properties for Organic and Inorganic Chemicals. New York: McGraw-Hill, 1999. 779. Print.
Calor Específico de Líquidos Orgânicos
Cp [J/mol/K], T[K]
Fórmula A B C D Tmin Tmax Cp@ 25C
CH4 -0,02 1,20 -9,9e-3 3,2e-5 92 172
C2H6O 59,3 3,64e-1 -1,2e-3 1,8e-6 160 465 107,4
H2O 92,1 -4,0e-2 -2,1e-4 5,4e-7 273 615 75,55
Yaws, Carl L. "Heat Capacity of Liquids." Chemical Properties Handbook: Physical, Thermodynamic, Environmental, Transport, Safety, and Health Related Properties for Organic and Inorganic Chemicals. New York: McGraw-Hill, 1999. 779. Print.
Calor Específico de Gases
Cp [J/mol/K], T[K]
Fórmula A B C D E Tmin Tmax
CH4 34,9 -4,00e-2 1,92e-4 -1,53e-7 3,93e-11 50 1500
CO 29,6 -6,6e-3 2,01e-5 -1,22e-8 2,26e-12 60 1500
CO2 27,44 4,23e-2 -1,96e-5 4,00e-9 -2,99e-13 50 5000
C2H6O 27,09 1,11e-1 1,10ee-4 -1,50e-7 4,66e-11 100 1500
H2 25,4 2,02e-2 -3,85e-5 3,19e-8 -8,76e-12 250 1500
H2O 33,93 -8,42e-3 2,99e-5 -1,78e-8 3,69e-12 100 1500
Ar
Yaws, Carl L. "Heat Capacity of Gases." Chemical Properties Handbook: Physical, Thermodynamic, Environmental, Transport, Safety, and Health Related Properties for Organic and Inorganic Chemicals. New York: McGraw-Hill, 1999. 779. Print.
Referências
- Newnham, R. E., Properties of Materials – Anisotopy, Symmetry, and Structure, Oxford, 2005.
